Разнородният характер на факторите определя необходимостта от мултидисциплинарен подход към диагностиката и лечението на загубите на плода и жените с репродуктивни неуспехи вече не са пациенти само на акушер-гинеколози, а и на по-широк кръг специалисти – ендокринолози, генетици, имунолози.
1. Имунологични фактори, влияещи върху развитието на гаметите: 1) Експресия на HLA антигени; 2) Антиспермални антитела; 3) Антиовариални антитела
2. Имунологични фактори, влиящи върху формирането на бластоцист /трофобласт 1) Антифосфолипидни антитела; 2) Анти-трофобластни антитела; 3) Анти-ендометриални антитела; 4) Ендометриални адхезионни фактори; 5) Т-лимфоцити; 6) NK-клетки
3. Имунологични фактори, влиящи върху имплантацията: Th1/Th2 баланс
4. Имунологични фактори, влиящи върху феталното развитие и преживяемост: Анти-HLA антитела
Имунологичните фактори могат да индуцират две основни патогенетични усложнения: автоимунитет, когато клетъчен или хуморален имунен отговор е насочен към автоантигени на майката и алоимунитет, когато тези отговори са насочени към алоантигени на феталните тъкани.
Факторите, които са обект на интензивни проучвания при спонтанни аборти и рутинно се наложиха като минимум в диагностичните панели на водещите центрове по репродуктивна медицина, са: тромбофилични фактори (вродени – генни мутации, асоциирани с тромбофилия и придобити – антифосфолипидни антитела), автоантитела (включително анти-тиреоидни) и NK лимфоцити. Тяхното изследване в хода на диагностичния процес при жени с повтарящи се аборти, допринася не само за изясняване на причините и тяхното последващо лечение, но също така и за диагностициране на други заболявания като: системни автоимунни, антифосфолипиден синдром, автоимунни тиреоидити, вродена тромбофилия. По този начин, комплексният диагностичен подход към повтарящите се загуби на плода е важен за общото здраве на жената и за откриването на заболявания, чиито първи клинични изяви са спонтанните аборти.
Бременността е придобито хиперкоагулабилно състояние и успешният изход зависи от адекватната плацентарна циркулация. Най-честите предразполагащи фактори за тромбоемболизъм по време на бременноста са наследствената и придобита тромбофилия. Майчината тромбофилия може да предизвика редица патофизиологични нарушения с аномалии в плацентарното кръвообращение и да съдейства за усложнения на бременността, като тромбози на плацентата, плацентарна абрупция, интраутеринно забавяне в растежа на плода, прееклампсия, спонтанни аборти и мъртвораждания [11].
Генни мутации, асоциирани с тромбофилия
В редица проучвания се установява, че около 60% от жени с повтарящи се спонтанни аборти са носители на унаследен дефект, предразполагащ към тромбофилия, сравнено с около 15% при такива, които са без репродуктивни неуспехи, като комбинирана тромбофилия, т.е носителство на повече от един унаследен дефект се наблюдава до 5 пъти по-често при жени с репродуктивни неуспехи. [12]. Трите най-чести генетични дефекти за тромбофилия, известни като предразполагащи към развитие на венозни тромбози са: мутация G1691A в гена на Фактор V Leiden (FVL), мутация G20210A в протромбиновия ген (PR) и мутация C677T в гена на ензима метилентетрахидрофолатредуктаза (MTHFR) [11, 13].
Мутацията FVL е един от най-честите генетични дефекти, свързани с вродена тромбофилия. Тя представлява нуклеотидна замяна на G c A на 1691 място в нуклеотидната верига, което води до замяна на аминокиселината аргинин с глутамин на 506 място в полипептидната верига на белтъка. Активният FVL в нормални условия се инактивира от комплекс, изграден от активен протеин С (АРС) и протеин S. Промяната в конформацията на FVL десетократно забавя инактивирането му, в резултат на което той се задържа по-дълго в кръвната циркулация, довеждайки до състояние на хиперкоагулация и увеличен риск за тромбоза [14, 15]. Мутацията FVL се открива в 20-40% от случаите с венозен тромбемболизъм и в 3-5% от общата популация [16, 17]. Според наши [18] и други проучвания [19, 20], носителството на FVL е рисков фактор за загуба на плода във втори триместър (OR-11.0) и повторяемост ≥3 загуби на плода (OR-8.7).
Хиперхомоцистеинемията се разглежда като самостоятелен фактор, увреждащ съдовия ендотел, и предразполагащ към активиране на коагулационната система. Като най-честа причина за повишено ниво на хомоцистеин в кръвта се счита мутация C677T в гена на ензима MTHFR. Химерхомоцистеинемия е установена в около 26% при бременни с преждевременно отлепване на плацентата и в 31% при жени с преждевременно стареене на плацентата и плацентарни инфаркти, сравнено с около 9% при бременни без такива усложнения на бременността [21, 22, 23]. Нашите данни [18, 24], както и на други автори [13, 25, 26] показват, че честотата на дефекта при жени със загуби на плода е около 2 пъти по-висока от тази в контролите, като носителството му повишава около 2.5 пъти риска през първи триместър и не показа асоциация с повторяемостта на загубите.
Мутацията (G20210A) в PR представлява еднонуклеотидна замяна на гуанин с аденин на 20210 място в 3’нетранслируемия участък на PR. Тя е свързана с повишено ниво на протромбин в кръвта, съответно увеличаване на тромбин и нарушена инактивация на фактор Vа от АРС. Счита се, че 16% от тромбемболичните заболявания се дължат на този генетичен дефект, като честотата на хетерозиготите по мутантния алел е от порядъка на 3% от здравото население [27, 28, 29]. Наше [18] и други проучвания [19, 30, 31] показват, че мутацията G20210A е с 2 до 4 пъти по-висока честота сред жени със загуби на плода в сравнение със здрави контроли, като носителството е свързано със среден по величина риск в първи триместър и с повторяемост на загубите ≥2.
Противоречиви са мненията относно показанията за изследване за генни дефекти, асоциирани с тромбофилия. Нашият опит и алгоритъм съвпадат с мненията на някои автори относно следните групи пациенти, които следва да бъдат изследвани активно преди планиране на бременност: 1) Жени с история за дълбоки венозни тромбози; 2) Жени с фамилна история за такива прояви, както и родственици от първа степен на носители на наследствена тромбофилия; 3) Асимптоматични жени без история за тромбемболични събития, но с история за повтарящи се загуби на плода или др. съдови усложнения на бременноста [11, 32].
Положителните резултати предполагат повишен риск за предстоящите бременности и прилагането на антикоагулантна терапия повишава процента на успешните бременности при такива жени (до 75% при лекувани жени, в сравнение с 20% при нелекувани [11].
Антифосфолипидните антитела (aPL) са автоантитела, насочени срещу отрицателно заредени фосфолипиди (кардиолипин, фосфатидилсерин, фосфатидилинозитол и др.) и фосфолипид-свързващи протеини (бета2-гликопротеин І, протромбин). Те могат да бъдат насочени срещу фосфолипидни антигени, разположени върху клетъчните мембрани (тромбоцити, ендотелни клетки, трофобластни клетки), в комплекси с ко-фактори – плазмени протеини (бета2-гликопротеин І) [33, 34] или директно срещу плазмени протеини без фосфолипидни антигени [35]. Установено е, че свързването на aPL с фосфолипиди може да зависи от плазмени протеини като протромбин, анексин V, Фактор Ха, протин С, протеин S и др. [36]. Следователно aPL могат да бъдат разглеждани като хетерогенна група от антитела, насочени срещу бета2-гликопротеин І и фосфолипидни епитопи, стабилизирани от взаимодействието им с други протеини.
Най-честата клинична изява на aPL са репродуктивните неуспехи – повтарящи се загуби на плода, прееклампсия, интраутеринна ретардация на плода, плацентарна абрупция, мъртвораждане [37, 38, 39]. Асоциацията на aPL със загуби на плода и/или други клинични изяви (артериални или венозни тромбози) е известна като антифосфолипиден синдром. aPL могат да влияят върху бременността от етапа на сформиране на бластоцист/трофобласт до раждането. Патогенетичните ефекти на aPL върху бременността са разнородни и включват: 1) инхибиране на трофобластната инвазия и продукция на хормони (beta-hCG); 2) свързване с трофобластни клетки и инхибиране сформирането на синцитиотрофобласт; 3) инхибиране диференциацията на екстравилозния трофобласт; 4) повишено съотношение тромбоксан/простациклин в плацентата и тромбози на утероплацентарната повърхност; 5) тромбози на спиралните артерии след повишена тромбоцитна агрегация, понижена активация на протеин С, повишена експресия на тъканен фактор и повишена синтеза на тромбоцит активиращ фактор (PAF); 6) хроничен утероплацентарен васкулит, плацентарна тромбоза и инфаркт, интервилозит, вилозит и др. [40, 41, 42].
Съществуват противоречия в литературата относно: кои aPL имат патогенетично значение за бременността, каква е тяхната честота и в кой триместър е значима тяхната роля. Съществува консенсус относно изследването на лупус антикоагулант (LA) и антикардиолипин антитела при жени с повтарящи се загуби на плода, т.к. 1) те са сигнификантно увеличени при тези групи пациенти; 2) прогнозата на бременността при пациенти с такива антитела е по-лоша спрямо контролите и 3) лечението с хепарин и аспирин при тези пациенти показва по-висок процент на успешни бременности [43, 44, 45]. Проучвания на Stern и сътр. [46, 47] убедително доказват, че анти-бета2-гликопротеин І антителата от клас ИгМ също се асоциират с повтарящи се спонтанни аборти и IVF неуспехи. Установени са различни честоти на aPL в зависимост от срока на загубите на плода: 16-38% при ранни загуби на плода [48, 49], 2-16% при аборти в първи триместър [50, 51, 52], и 41-80% при аборти в късен първи, втори и трети триместър [53, 54].
Литературата изобилства с доказателства за асоцииране на субклинични автоимунни заболявания с репродуктивни неуспехи. Първоначално е доказана връзка с наличието на LA [55] и aPL [56], а в последствие и с анти-тиреоидни [57, 58] и различни други автоантитела [59]. През 1988, Gleicher и сътр. въвеждат понятието Синдром на репродуктивна автоимунна недостатъчност (RAFS) [60], отнасящ се до пациентки, при които автоантителата се асоцират единствено с репродуктивна недостатъчност. Известно е, че автоимунни заболявания като SLE, антифосфолипиден синдром, ревматоиден артрит, захарен диабет Тип І и др., сами по себе си са риск за бременността, но пациентки с такива заболявания са имали спонтанни аборти преди поставянето на диагнозата. Тази асоциация от една страна потвърждава патогенетичната роля на автоантителата за загубите на плода, а от друга – предполага автоимунен поликлонален характер на загубите, подобно на поликлоналния характер на самите заболявания. Вече се приема за малко вероятно единствено LA или антикардиолипин антитела да индуцират спонтанни аборти. Предполага се участието на повече от едно автоантитяло и други автоимунни механизми.
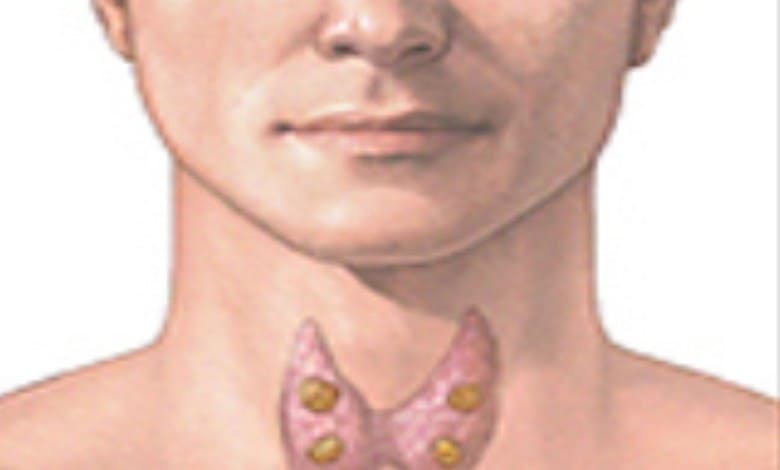
Специално внимание предизвиква тиреоидния автоимунитет. Поне 18 контролирани проучвания (10 проспективни и 8 case-control) и техният мета-анализ показват сходна сигнификантна връзка между тиреоидните автоантитела и спонтанните аборти [61]. Предполагаемите механизми са: 1) асоциация на тиреоидните автоантитела с други автоантитела (SLE, антикардиолипин), които сами по себе си са висок риск [62]; 2) в случаи на селектирани групи без други автоантитела, се предполага друг подлежащ автоимунен механизъм, като напр. повишени CD5+CD20+ B-лимфоцити при жени с повтарящи се аборти и анти-тиреоидни антитела [63] или абнормни Т-клетъчни функции [64]; 3) наличие на други асоциирани неимунологични фактори като възраст и тиреоидна функция [65]. Установено е, че еутиреоидни жени с анти-ТРО антитела са средно със 6 години по-възрастни и имат умерено повишен TSH спрямо анти-ТРО негативни жени [65]. По-високата възраст на жената и хипофункцията на щитовидната жлеза, особено в период на високи изисквания, какъвто е бременността, са рискови фактори за загуба на плода [66].
NK лимфоцити
Около 10% от ендометриалните стромални клетки в пролиферативната фаза, 20% в секреторната и 30% от децидуалните стромални клетки през ранна бременност са левкоцити. От тях съществен дял се състои от eстествени клетки убийци (Natural killers cells, NK), като през първи триместър, те са 70% от децидуалните стромални левкоцити [67]. NK клетките са популация от лимфоцити с уникални фенотипни характеристики и функционални качества. Те биват периферни и утеринни (ендометриални или децидуални), като двете субпопулации се различават фенотипно и функционално, а също така, самите те се променят в зависимост от фазата на менструалния цикъл и по време на бременност.
Утеринните NK лимфоцити се различават от тези, циркулиращи в периферна кръв, по своя антигенен фенотип – CD3-CD56brightCD16- [68]. Използваните от различните автори синоними за тези клетки са: големи гранулирани лимфоцити, ендометриални гранулоцити, К клетки, ендометриални гранулирани лимфоцити и децидуални гранулирани лимфоцити. Терминът „утеринни NK лимфоцити” е подходящ, т.к обединява различните субпопулации на ендометриални и децидуални NK лимфоцити. Множество проучвания през последните две десетилетия потвърждават ролята на утеринните NK лимфоцити за успешното реализиране и изход на бременността. Те са обилни в децидуата около инфилтриращите екстравазални трофобластни клетки [69] и изпълняват следните основни функции: 1) Регулация на трофобластния и плацентарен растеж чрез продукция на цитокини (GM-CSF, CSF, LIF, IFN-gamma) [70-72]; 2) Локална имуномодулация чрез галектин-1 (инхибиране на Т-клетъчна пролиферация) и гликоделин А (подтискане на Т-клетъчна активация) [73]; 3) Контрол върху трофобластната инвазия чрез клетъчно-медиирана цитотоксичност [74].
Утеринните NK клетки имат противоположните свойства да протектират и инхибират растежа на ембриона. Промените в броя, фенотипа и функциите им могат да влияят върху неблагоприятния изход на бременността [75]. Понижен брой CD56bright/CD16- клетки и повишени CD56bright/CD16+ в плацентарни биопсии са установени при жени със загуби на плода [76, 77]. Репродуктивният неуспех при CD56bright/CD16- и CD56bright/CD16+ дисбаланс може да е резултат от CD16+ и Il-2 индуцирана цитокинова секреция, NK клетъчна цитотоксичност и Th1 имунни реакции срещу трофобласта [77].
Периферните NK лимфоцити (CD3-CD56dim/CD16bright) също показват промяна в субпопулациите си в зависимост от фазата на менструалния цикъл и бременността. Те също могат да бъдат асоциирани с репродуктивен неуспех [78-80]. Установено е, че жени с повтарящи се загуби на плода имат повишени периферни CD3-CD56+CD16+ NK лимфоцити, в сравнение с контролите [78]. Жени с повтарящи се аборти и висока пре-концептуална NK клетъчна активност имат сигнификантно по-висок брой последващи аборти в сравнение със жените с нормални пре-концептуални NK стойности [79].
Флоуцитометричното изследване на CD3-CD56+CD16+ NK лимфоцити в периферна кръв при жени с повтарящи се загуби на плода е достъпен метод за оценка на този рисков фактор при планиране на бременност, както и по време на бременността.
Собствен алгоритъм за диагностика и терапия при загуби на плода
За първи път, през 1995 година приложихме интравенозна гама глобулинова терапия при бременна жена с два предшестващи спонтанни аборта и установени антифосфолипидни антитела. От тогава до сега, в Центъра се разработи и прилага собствен алгоритъм за диагностика и терапия на загубите на плода. Подходът ни е разработен на базата на обширни литературни данни, колаборация с водещи специалисти от САЩ и Европа и най-вече – чрез натрупване на собствен опит, чиято висока успеваемост потвърждава правилния избор на клинично поведение.
1. Селекция на пациенти, показани за изследване:
Един от основните въпроси е кои жени и кога са показани за диагностично уточняване. Изследвания могат да се правят както след регистриране на загуба, така и по време на настояща бременност. Най-добре е, обаче, всички изследвания и консултации да са проведени преди планиране на следваща бременност. След първична консултация, показани за изследване са следните групи пациенти: 1) Жени без живородено дете, с анамнеза за два или повече последователни спонтанни аборта (преди 22 г.с); 2) Жени без живородено дете, с анамнеза за едно или повече мъртвораждания (след 22 г.с); 3) Жени без живородено дете, с кървене ex utero по време на настояща бременност и анамнеза за един спонтанен аборт; 4) Жени с едно живородено дете и последващи два или повече спонтанни аборта; 5) Жени с едно живородено дете и последващи едно или повече мъртвораждания; 6) Жени с анамнеза за ретардация на плода при предшестваща бременност; 7) Жени с ретардация на плода при настояща бременност; 8) Жени с анамнеза за пре-еклампсия при предшестваща бременност; 9) Жени с пре-еклампсия в настояща бременност.
2. Диагностични панели:
В зависимост от общата и акушерска анамнеза на жената, лекарят назначава един или повече от следните диагностични панели: 1) Панел за тромбофилия: генни мутации, асоциирани с тромбофилия (G1691A в гена на FVL, G20210A в PR, C677T в гена на MTHFR, генетичен вариант в гена на тромбоцитен гликопротеин ІIb/IIIа – носителство на хаплотип А2, 4G/4G PAI-1) и антифосфолипидни антитела; 2) Панел за тиреоидна функция: FT4, TSH, анти-тиреоглобулин и анти-ТРО антитела; 3) Имунологичен панел: антифосфолипидни антитела, други автоантитела (ANA, dsDNA, и др.) периферни CD3-CD56+CD16+ NK лимфоцити; 4) Медико-генетично изследване: цитогенетичен анализ за изключване на носителство на балансирани хромозомни изменения.
При необходимост, в зависимост от получените резултати и анамнезата, се назначават консултации със съответния специалист: медико-генетична консултация, консултация с ендокринолог и ехография на щитовидната жлеза; консултация с клиничен имунолог. Специалистът проследява жената и по време на бременността.
4. Терапия
Прилаганата от нас терапия включва комбинации от следните групи препарати: антиаграганти – Aspirin (100 mg/ ден); антикоагуланти – ниско-молекулен хепарин (Fraxiparin, Clexan); имуномодулатор – интравенозен гама-глобулин (Immunovenin intact); препарати, подтискащи активността на NK клетките – Intralipid; хормонални препарати, препарати на фолиевата киселина; мултивитаминни препарати и др.
Схемите за терапия при всяка жена са индивидуални и се оформят на базата на получените разултати, проведените консултации и историята на предшестващите загуби на плода. По наши наблюдения, терапията гарантира висока успеваемост, когато отговаря на следните условия: 1/ започва при планиране на бременност или възможно най-рано след регистриране на бременността; 2/ комбинира принципите на имуномодулация и антикоагулантна терапия; 3/ преценява се индивидуално в хода на бременността, в зависимост от мониториране на лабораторните показатели и ехографския контрол на плода и плацентата.